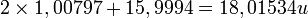Estequiometria: Leis, Mol, Volume Molar e Massas
Classificado em Química
Escrito em em  português com um tamanho de 5,52 KB
português com um tamanho de 5,52 KB
Leis Fundamentais da Estequiometria
Lei da Conservação da Massa (Lei de Lavoisier)
A Lei da Conservação da Massa, ou Lei da Conservação da Matéria (também conhecida como Lei de Lavoisier-Lomonosov), estabelece que, em uma reação química ordinária, a massa permanece constante. Ou seja, a massa dos reagentes consumidos é igual à massa dos produtos obtidos.
Lei das Proporções Múltiplas (Lei de Dalton)
A Lei de Dalton, ou Lei das Proporções Múltiplas, formulada em 1803 por John Dalton, é uma das leis estequiométricas mais básicas. (Esta lei foi demonstrada pelo químico e físico francês Joseph Louis Gay-Lussac.)
Lei das Proporções Recíprocas (Lei de Richter-Wenzel)
A Lei das Proporções Recíprocas, também chamada de Lei dos Pesos de Combinação ou Lei Recíproca (ou Lei de Richter-Wenzel), estabelece que os pesos dos diferentes elementos que se combinam com o mesmo peso de um determinado elemento são os pesos relativos com que esses elementos se combinam, ou múltiplos ou frações desses pesos.
Volume Molar e o Conceito de Mol
Volume Molar
O Volume Molar de uma substância, simbolizado $V_m$ [1], é o volume de um mol da mesma. A unidade do Sistema Internacional de Unidades (SI) é o metro cúbico por mol: m³·mol⁻¹.
O Mol e o Número de Avogadro
Um mol de qualquer substância contém $6,022 imes 10^{23}$ partículas. [2] No caso do mol gasoso molecular, ele contém $N_A$ moléculas (Número de Avogadro). Disto se segue, tendo em conta a Lei de Avogadro, que um mol de qualquer substância gasosa ocupará sempre o mesmo volume (medido sob as mesmas condições de pressão e temperatura).
Experimentalmente, foi demonstrado que o volume ocupado por um mol de qualquer gás ideal nas Condições Normais de Temperatura e Pressão (CNTP: Pressão = 1 atm, Temperatura = 273,15 K ou 0 °C) é de 22,4 litros. [3] Este valor é conhecido como Volume Molar Normal de um Gás.
Gases Ideais e Reais
Este valor corresponde ao volume molar dos chamados gases perfeitos ou ideais. Os gases comuns não são ideais (suas moléculas têm um volume próprio, ainda que pequeno) e seu volume molar desvia-se ligeiramente deste valor. Assim, o volume molar de alguns gases reais é:
- Monóxido de carbono (CO): 22,4 L.
- Dióxido de enxofre (SO2): 21,9 L.
- Dióxido de carbono (CO2): 22,3 L.
No caso de substâncias sólidas ou líquidas, o volume molar é muito menor e diferente para cada substância. Por exemplo:
- Nitrogênio líquido (-210 °C): o volume molar é de 34,6 cm³.
- Água líquida (4 °C): o volume molar é de 18,0 cm³.
Massa Atômica e Molecular
Massa Atômica
A Massa Atômica ($m_a$) é a massa de um átomo, geralmente expressa em unidade de massa atômica (u.m.a.) [1]. A massa atômica pode ser considerada como a massa total de prótons e nêutrons em um átomo (quando o átomo está em repouso). A massa atômica é por vezes usada incorretamente como sinônimo de massa atômica relativa, massa atômica média e peso atômico, sendo que este último difere sutilmente da massa atômica. A massa atômica é definida como a massa de um átomo, que só pode ser de um isótopo de cada vez, e não é uma média ponderada das abundâncias dos isótopos.
O Mol como Unidade SI
O mol (símbolo: mol) é a unidade que mede a quantidade de substância, uma das sete grandezas físicas fundamentais do Sistema Internacional (SI).
1 mol equivale a $6,02214179(30) imes 10^{23}$ partículas.
Massa Molecular Relativa
A Massa Molecular Relativa é um número que indica quantas vezes a massa de uma molécula de uma substância é maior do que a unidade de massa atômica. Sua unidade é o Dalton (Da) ou unidade de massa atômica, abreviada como u (anteriormente u.m.a.).
A massa molecular é determinada pela soma das massas atômicas relativas dos elementos cujos átomos formam uma molécula dessa substância. Embora seja popularmente chamado de peso molecular, o termo correto é massa molecular. A massa molar de uma substância coincide numericamente com a massa molecular, embora sejam grandezas diferentes.
Cálculo da Massa Molecular
A fórmula para o cálculo da percentagem de um elemento (X) na molécula é: % X = [(Nº de átomos de X) · Ar(X) / Mr] * 100%
A massa molecular é calculada pela soma das massas atômicas dos elementos da molécula. Assim, no caso da molécula de água, H2O, a sua massa molecular é:
(Massa atômica do H: 1,00797; Massa atômica do O: 15,9994)
O valor da massa atômica do Hidrogênio é multiplicado por 2, pois a molécula de água contém dois átomos de hidrogênio (H).