Teorias de Ácidos, Bases e Sais em Química
Classificado em Química
Escrito em em  português com um tamanho de 9,3 KB
português com um tamanho de 9,3 KB
Definições de Ácidos
Ácido, segundo Arrhenius (1887), é toda substância que, em solução aquosa, libera única e exclusivamente íons H+. Um exemplo é o ácido clorídrico, de fórmula HCl:
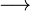 H+ + Cl –
H+ + Cl –Alguns anos mais tarde, em 1923, Brønsted e Lowry propuseram a ideia de que ácido é uma substância que pode ceder prótons (íons H+).
Esta última definição generaliza a teoria de ácidos de Arrhenius. A teoria de Brønsted e Lowry de ácidos também serve para dissoluções não aquosas; as duas teorias são muito parecidas na definição de ácido, mas a de Brønsted-Lowry é muito mais geral.
Lewis em 1923 ampliou ainda mais a definição de ácidos, teoria que não obteve repercussão até alguns anos mais tarde. Segundo a teoria de Lewis, um ácido é aquela espécie química que, em qualquer meio, pode aceitar um par de elétrons. Desta forma, incluem-se substâncias que se comportam como ácidos, mas não cumprem a definição de Brønsted e Lowry, sendo denominadas ácidos de Lewis. Visto que o protão, segundo esta definição, é um ácido de Lewis (tem vazio o orbital 1s, onde pode alojar-se o par de elétrons), pode-se afirmar que todos os ácidos de Brønsted-Lowry são ácidos de Lewis, e todos os ácidos de Arrhenius são de Brønsted-Lowry.
- Exemplos de ácidos de Brønsted e Lowry: HCl, HNO3, H3PO4 - se doarem o H+ durante a reação.
- Se estiverem em solução aquosa, também são ácidos de Arrhenius.
Definições de Bases
Bases,
Segundo Svante Arrhenius, uma base (também chamada de álcali) é qualquer substância que libera única e exclusivamente o ânion OH– (íons hidroxila ou oxidrila) em solução aquosa. Soluções com estas propriedades dizem-se básicas ou alcalinas. As bases possuem baixas concentrações de íons H+, sendo consideradas base as soluções que têm pH acima de 7. Possuem sabor adstringente (ou popularmente, cica) e são empregadas como produtos de limpeza, medicamentos (antiácidos), entre outros. Muitas bases, como o hidróxido de magnésio (leite de magnésia) são fracas e não trazem danos. Outras como o hidróxido de sódio (NaOH ou soda cáustica) são corrosivas e sua manipulação deve ser feita com cuidado. Quando em contato com o papel tornassol vermelho, apresentam a cor azul-marinho ou violeta.
Em 1923, o químico dinamarquês Johannes Nicolaus Brønsted e o inglês Thomas Martin Lowry propuseram a seguinte definição: Uma base é um aceitador de prótons (íon hidrônio H+).
Mais tarde Gilbert Lewis definiu como base qualquer substância que doa pares de elétrons não ligantes, numa reação química - doador do par eletrônico.
Neutralização de Ácidos e Bases
As bases neutralizam os ácidos, segundo o conceito de Arrhenius, formando água e um sal:
- H2SO4 + Ca(OH)2 ? 2 H2O + CaSO4
- (ácido sulfúrico + hidróxido de cálcio = água + sulfato de cálcio)
- HCl + NaOH ? H2O + NaCl
- (ácido clorídrico + hidróxido de sódio = água + cloreto de sódio)
Sais
Nota: Para outros significados de Sal, ver Sal (desambiguação).
Em química, um sal é um composto iônico, ou seja, formado por cátions e ânions. Eles são tipicamente o produto de uma reação química entre:
Um metal e um ácido: forma-se um sal e hidrogênio. Por exemplo: Um óxido ácido e um óxido básico: forma-se um sal. Por exemplo:Os íons que formam os sais podem ser monoatómicos (como o ânion fluoreto, F-, ou o cátion cálcio, Ca2+) ou poliatómicos (como o ânion sulfato, SO42-). Podem ainda ser inorgânicos (como o já referido sulfato) ou orgânicos (como o ânion acetato, CH3COO–).
Em geral, os sais formam cristais. São frequentemente solúveis em água, onde os dois íons se separam. Os sais em geral têm um alto ponto de fusão, reduzida dureza e pouca compressibilidade. Se fundidos ou dissolvidos em água, conduzem eletricidade, pois dissociam-se nos seus íons constituintes, passando estes a funcionar como eletrólitos.
O sal mais popularmente conhecido é o cloreto de sódio, vulgarmente conhecido como "sal comum" ou "sal da cozinha", por ser largamente utilizado na alimentação humana.
A neutralização dos ácidos pelas bases pode ser total ou parcial, dando origem a sais ácidos ou básicos.
Óxidos
Um óxido é um composto químico binário formado por átomos de oxigênio com outros elementos. Os óxidos constituem um grande grupo na química, pois a maioria dos elementos químicos formam óxidos. Alguns exemplos de óxidos com os quais convivemos são: ferrugem (óxido de ferro III), gás carbônico (óxido de carbono IV ou dióxido de carbono), cal (óxido de cálcio).
Nos óxidos, o elemento mais eletronegativo deve ser o oxigênio. Os compostos OF2 ou O2F2 não são óxidos, pois o flúor é mais eletronegativo que o oxigênio. Estes compostos são chamados fluoretos de oxigênio.
